FINANCEMENT : IDEX Emergence en recherche 2021-2023. 48 000 €
Les métabolites secondaires (SMs) sont de petites molécules bénéfiques pour l’organisme producteur et présentent une grande diversité chimique. Même si les fonctions physiologiques précises de la majorité des SMs fongiques sont encore inconnues, il est communément admis que certaines d’entre elles jouent un rôle crucial pour le « bien-être » des organismes producteurs. Elles sont impliquées dans les processus de développement ou peuvent également jouer un rôle important pour les champignons en tant que moyens de défense ou armes contre les concurrents, comme l’a récemment examiné (Keller 2019). En ce qui concerne les avantages pour l’homme, les champignons représentent une source illimitée de métabolites bioactifs qui peuvent trouver des applications en thérapeutique, comme l’illustre l’antibiotique pénicilline (Li and Vederas 2009). En ce qui concerne les avantages pour l’homme, les champignons représentent une source illimitée de métabolites bioactifs qui peuvent trouver des applications en thérapeutique, comme l’illustre l’antibiotique pénicilline (Li and Vederas 2009).
Les annularines sont de petites molécules découvertes dans diverses espèces de champignons (Li et al. 2003; Pinheiro et al. 2016). Ces métabolites secondaires sont constitués d’un noyau α-pyrone, substitué en position 6 par différentes chaînes allant de 4 à 5 carbones. De nombreux métabolites, également isolés de champignons, sont proches des annularines et portent l’unité α-pyrone. A titre d’exemple, on peut citer les claudobotrines (Tezuka et al. 1994) et les phomones (Sang et al. 2017). De plus, certains de ces composés, tels que les avertoxines (Wang et al. 2015), les asteltoxines (Wang et al. 2016) ou les aurovertines (Zhao et al. 2016), présentent plusieurs bioactivités, notamment un effet inhibiteur de l’acétylcholinestérase, des activités antitumorales, antivirales et antibactériennes.
L’annularine F a récemment été isolée de Podospora anserina par notre consortium (résultat non publié). Néanmoins, l’étendue des α-pyrone polykétides présents dans la souche P. anserina n’est pas encore connue, de même que le groupe de gènes responsables de leur biosynthèse.
ANFIPA est un projet interdisciplinaire consacré à la compréhension approfondie du métabolisme des annularines et de sa régulation chez le champignon modèle filamenteux P. anserina.
Dans ce contexte ce que nous proposons à travers le projet ANFIPA est de :
(1) identifier et isoler les annularines dans P. anserina par le développement de procédures analytiques fiables ;
(2) identifier le(s) groupe(s) impliqué(s) dans la synthèse des annularines chez P. anserina et caractériser les phénotypes des mutants de délétion et de surexpression que nous construirons, afin de mieux comprendre le rôle des annularines dans la physiologie du champignon ;
(3) élucider la voie de biosynthèse des annularines, par un profilage moléculaire basé sur le réseau moléculaire.
Par conséquent, ce projet est divisé en trois tâches principales interconnectées.
Tâche 1 : Approche analytique
Empreinte moléculaire basée sur les réseaux moléculaires de P. anserina cultivé dans des conditions standard (souche de type sauvage) afin d’explorer la diversité moléculaire des annularines produites par la souche. Elle peut être utilisée comme un outil fiable qui facilite l’exploration du métabolome de la souche et permet la détection de nouveaux analogues d’annularines putatifs.
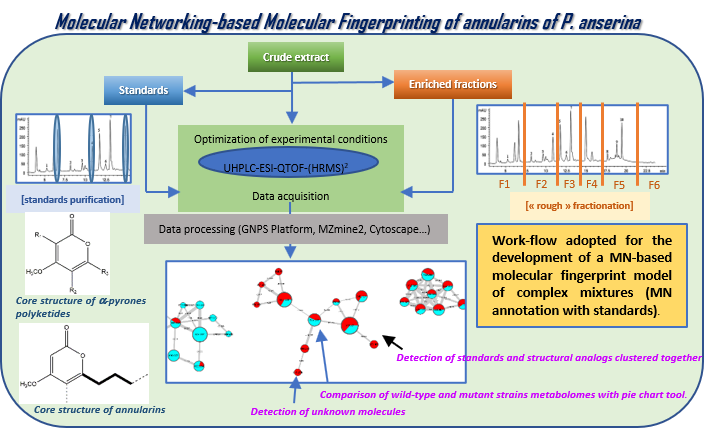
Stratégie de construction du modèle d’empreintes moléculaires basé sur les MN
Tâche 2 : Approche moléculaire
1/ Identifier les BGCs impliqués dans la biosynthèse des annularines chez P. anserina.
2/ Mieux comprendre le rôle des annularines dans la physiologie du champignon.
Tâche 3 : Approche intégrative
Caractérisation de la voie de biosynthèse de l’annularine chez P. anserina. La méthodologie, basée sur un effort conjoint des deux partenaires, est appropriée pour étudier la voie de biosynthèse de l’annularine et le rôle des enzymes impliquées dans les étapes clés.
Notre projet est pour l’instant limité à la famille des annularines, qui n’est pas bien caractérisée, mais pourrait être étendu, en fonction des progrès du consortium, à d’autres membres de la famille des polykétides -pyrones ou à d’autres voies de biosynthèse des SM fongiques.
References:
Keller N. P., 2019 Fungal secondary metabolism: regulation, function and drug discovery. Nat. Rev. Microbiol. 17: 167–180. https://doi.org/10.1038/s41579-018-0121-1
Li C., M. V. Nitka, J. B. Gloer, J. Campbell, and C. A. Shearer, 2003 Annularins A-H: new polyketide metabolites from the freshwater aquatic fungus Annulatascus triseptatus. J. Nat. Prod. 66: 1302–1306. https://doi.org/10.1021/np030225y
Li J. W.-H., and J. C. Vederas, 2009 Drug discovery and natural products: end of an era or an endless frontier? Science 325: 161–165. https://doi.org/10.1126/science.1168243
Pinheiro E. A. A., F. C. Borges, J. R. S. Pina, L. R. S. Ferreira, J. S. Cordeiro, et al., 2016 Annularins I and J: New Metabolites Isolated from Endophytic Fungus Exserohilum rostratum. Journal of the Brazilian Chemical Society. https://doi.org/10.5935/0103-5053.20160140
Sang X.-N., S.-F. Chen, M.-X. Tang, H.-F. Wang, X. An, et al., 2017 α-Pyrone derivatives with cytotoxic activities, from the endophytic fungus Phoma sp. YN02-P-3. Bioorganic & Medicinal Chemistry Letters 27: 3723–3725. https://doi.org/10.1016/j.bmcl.2017.06.079
Tezuka Y., Q. Huang, T. Kikuchi, A. Nishi, and K. Tubaki, 1994 Studies on the Metabolites of Mycoparasitic Fungi. I. Metabolites of Cladobotryum varium. Chemical & Pharmaceutical Bulletin 42: 2612–2617. https://doi.org/10.1248/cpb.42.2612
Wang M., M. Sun, H. Hao, and C. Lu, 2015 Avertoxins A–D, Prenyl Asteltoxin Derivatives from Aspergillus versicolor Y10, an Endophytic Fungus of Huperzia serrata. J. Nat. Prod. 78: 3067–3070. https://doi.org/10.1021/acs.jnatprod.5b00600
Wang J., X. Wei, X. Qin, X. Tian, L. Liao, et al., 2016 Antiviral Merosesquiterpenoids Produced by the Antarctic Fungus Aspergillus ochraceopetaliformis SCSIO 05702. J. Nat. Prod. 79: 59–65. https://doi.org/10.1021/acs.jnatprod.5b00650
Zhao H., R. Wu, L.-F. Ma, L.-K. Wo, Y.-Y. Hu, et al., 2016 Aurovertin-Type Polyketides from Calcarisporium arbuscula with Potent Cytotoxic Activities against Triple-Negative Breast Cancer. Helvetica Chimica Acta 99: 543–546. https://doi.org/10.1002/hlca.201600026
PERSONNES ET LABORATOIRES IMPLIQUES :
Ce projet implique deux équipes reconnues dans leurs domaines d’expertise respectifs, appartenant toutes deux à l’Université de Paris :
– l’équipe B2C (UMR CNRS LIED 8236, Faculté des Sciences) pour le génie génétique et les méthodes dépendantes de la culture fongique. Gwenaël RUPRICH-ROBERT (co-porteuse), Eva CABET et Florence CHAPELAND-LECLERC.
– l’équipe PNAS (UMR CNRS CiTCoM 8038 – Faculté de Santé) pour le profilage moléculaire par l’utilisation de réseaux moléculaires, l’extraction, l’isolation et l’élucidation structurale des SMs. Xavier Cachet (co-porteur) et Thomas Gaslonde.
Une étudiante titulaire d’une bourse doctorale China Scholar Chips (CSC), Xiaoyue Peng, a été recrutée depuis octobre 2021 sur ce projet.